#9 hypoxia-inducible factor 1,低酸素誘導性因子1
wikipediaに解説が掲載されている。
英語版(参照)、日本語版(参照)ともに記述は古典的な知見とその解釈を知るためには有用かも知れない。
英語版には遺伝子に関する情報が掲載されていて便利である。
しかし、明確な誤りも存在するので注意が必要である。
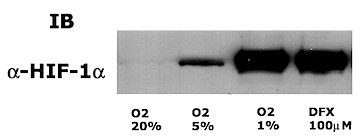
誘導性因子という名前は、培養細胞酸素分圧に逆相関してHIF-1α蛋白質の発現量が増加することに由来する。
この細胞内蛋白質蓄積はHIF-1αのmRNAが低酸素環境下で誘導を受けたというよりはHIF-1α 蛋白質のmRNAからの新生、蛋白質の破壊のバランスで決定されているということが培養細胞を用いた検討により1993年には判明していた。(cDNA cloingより先に!!)
GL Wang and GL Semenza
Characterization of hypoxia-inducible factor 1 and regulation of DNA binding activity by hypoxia
J. Biol. Chem., Oct 1993; 268: 21513 – 21518
Guang L. Wang and Gregg L. Semenza
Purification and Characterization of Hypoxia-inducible Factor 1
J. Biol. Chem., Jan 1995; 270: 1230 – 1237 ; doi:10.1074/jbc.270.3.1230
この論文は必読である。
このような古典的な手法を使いある種の力業でHIF-1のcDNA単離に成功したのである。Semenza氏が「自分は熱心なポスドクに恵まれた、labの成否はいかに優秀なポスドクを獲得できるかで決まるのだ」と聞かされたことがある。
Hep3B細胞を用いたWestern blot
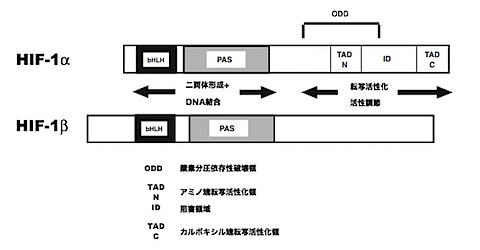
HIF-1α は機能的にわけられるいくつかのドメインで構成されている。
N側(ヒトではアミノ酸配列の1-501番くらいまで)のDNA結合 (bHLH domain)、HIF-1β (Per-ARNT-Sim (PAS) domain )との二量体形成に関わる。
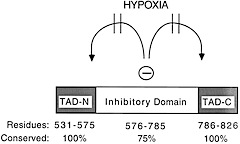
C側(アミノ酸531-826番まで)は、主に転写活性化に関わる機能を担っている。この大きなドメインは二つの転写活性化ドメインを含みその間にはID(inhibitory domain)と名付けられた介在配列が存在する。
Bing-Hua Jiang, Jenny Z. Zheng, Sandra W. Leung, Rick Roe, and Gregg L. Semenza
Transactivation and Inhibitory Domains of Hypoxia-inducible Factor 1. MODULATION OF TRANSCRIPTIONAL ACTIVITY BY OXYGEN TENSION
J. Biol. Chem., Aug 1997; 272: 19253 – 19260 ; doi:10.1074/jbc.272.31.19253より引用
Bing-Hua Jiang, Elizabeth Rue, Guang L. Wang, Rick Roe, and Gregg L. Semenza
Dimerization, DNA Binding, and Transactivation Properties of Hypoxia-inducible Factor 1
J. Biol. Chem., Jul 1996; 271: 17771 – 17778 ; doi:10.1074/jbc.271.30.17771参照のこと
HIF-1βは、aryl hydrocarbon receptor (AhR)とヘテロ二量体を形成するaryl hydrocarbon receptor nuclear translocatorとして知られていた蛋白質であった。HIF-1のcDNA単離により ARNTは HIF-1α とも二量体を形成し AhRとは別の遺伝子上の配列(hypoxia-response element; HRE)を認識する転写因子を構成することがわかった。つまりHIF-1のβ subunitはダイオキシン受容体を構成する分子である。
このように、研究の初期段階では細胞内でのHIF-1αの蛋白質発現量の調整がHIF-1活性調節における”要”と考えられていてこの調節の分子機構の解明へむけての研究が先行していた。
一方Semenza氏らは、HIF-1αの転写活性化能調節の重要性にいち早く着目していて、HIF-1αの転写活性化能調節は細胞内蛋白質発現量調節とは独立に酸素分圧で調整されている可能性を指摘した。この論文で示された実験事実を説明する因子として後に私たちが単離に成功したのがFIH-1である。
この時代にIDを機能的なドメインとして定立したSemenza氏はやはり慧眼の持ち主としかいいようがない。FIH-1の単離はこのドメインの存在の仮定故に成った。
Bing-Hua Jiang, Jenny Z. Zheng, Sandra W. Leung, Rick Roe, and Gregg L. Semenza
Transactivation and Inhibitory Domains of Hypoxia-inducible Factor 1. MODULATION OF TRANSCRIPTIONAL ACTIVITY BY OXYGEN TENSION
J. Biol. Chem., Aug 1997; 272: 19253 – 19260 ; doi:10.1074/jbc.272.31.19253
まとめると
HIF-1はアルファサブユニット(HIF-1α)とベータサブユニット(HIF-1β)からなる二両体であり二つのペプチドが疎水結合で結びつき一つの機能的な蛋白質を構成している。この内、低酸素応答性を司っているのはHIF-1α であることが分かっている。 HIF-1αは要約すると以下のような性質を持っている。
- 20%酸素下での培養状態では細胞内のHIF-1α の蛋白質の発現量は非常に低く抑えられているが酸素分圧の低下に反応して5%以下の培養条件で急激に蛋白質の発現量が増加する。
- 蛋白質量の変化とは独立して転写因子としての活性(転写活性化能)が酸素分圧の低下に伴い上昇する。
- 活性化したHIF-1は発現制御域(HRE)に結合し標的遺伝子の発現を促す。
HIF-1のこれらの性質を分子生物学的に理解することから低酸素感知機構の研究がスタートした。
しかし逆説的にHIF-1の活性化は低酸素条件下でのみ起こるわけでなくさまざまなHIF-1活性化因子が生体内、合成化合物を問わず発見されている。
HIF-1には近縁分子が存在する。現在存在が判明しているHIF-2, HIF-3はHIF-1とは別の遺伝子に由来してHIF familyを形作っている。